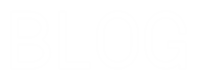Senyawa molekuler lebih mudah terbakar dibandingkan senyawa ion. Senyawa kovalen tidak memiliki kemampuan ini karena mereka tidak mengandung ion.

Perbedaan Senyawa Ion Dan Senyawa Kovalen Youtube
Senyawa ion juga lebih larut dalam air dibandingkan senyawa kovalen.

. Senyawa kovalen nonpolar timbul karena perbedaan elektronegativitas antaratom yang sangat kecil bahkan hampir sama. Pada senyawa kovalen yang memiliki lebih dari dua unsur kepolarannya ditentukan oleh beberapa hal berikut ini. Bila terdapat senyawa non polar terjadi gaya tarik dipol sesaat gaya dispersi gaya london gaya ini terjadi akibat muatan inti atom salah satu atom menginduksi elektron atom lain.
Senyawa ion umumnya larut dalam air senyawa kovalen umumnya tidak larut dalam air kecuali kovalen polar. Namun ada beberapa senyawa kovalen yang dapat larut dalam air karena terjadi reaksi dengan air hidrasi dan membentuk ion-ion. Senyawa-senyawa kovalen dengan ikatan kimia dengan kovalen nonpolar maka tidak ada muatan parsial baik positif maupum negatif.
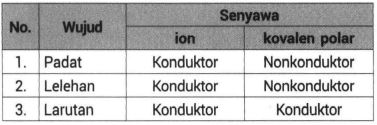
Oleh sebab itu larutan yang bersumber dari senyawa ionik dapat menghantarkan arus listrik dengan baik dan termasuk ke dalam larutan elektrolit kuat. Sedangkan logam ada yang mudah larut dalam air ada juga yang sukar larut dalam air. Senyawa ion dan senyawa kovalen memiliki perbedaan yaitu senyawa ion memiliki titik leleh yang lebih dibandingkan senyawa kovalen hanya sedikit yang larut dalam pelarut.
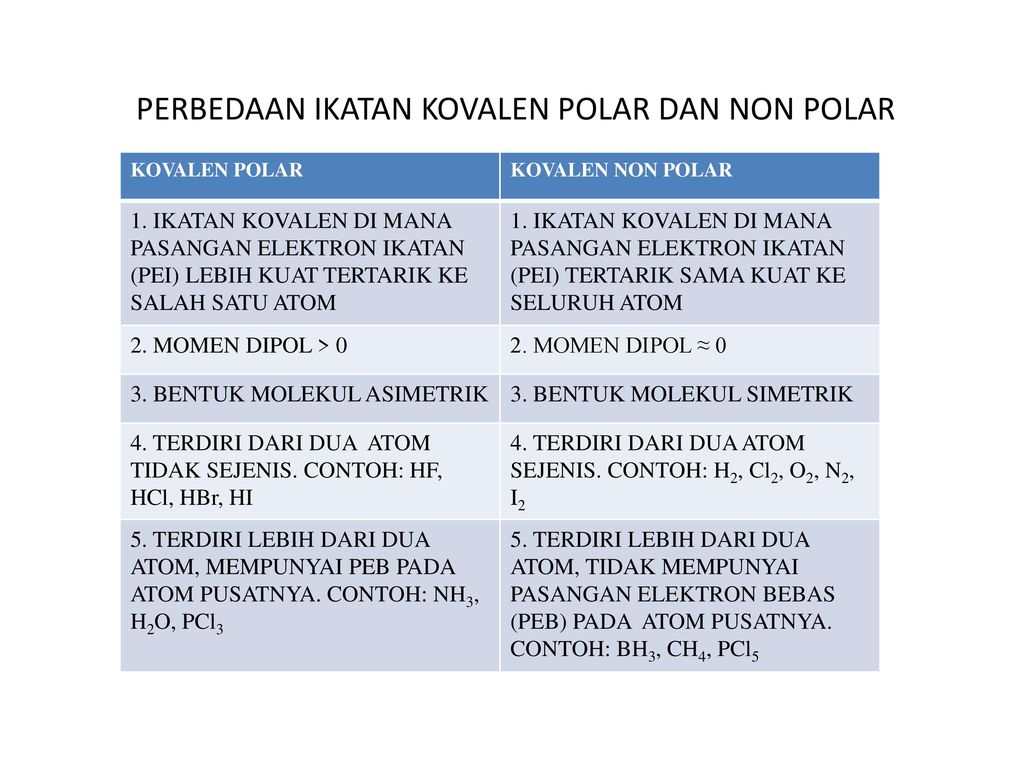
Senyawa kovalen polar hanya dapat menghantarkan listrik dalam larutan dan senyawa kovalen nonpolar tidak dapat menghantarkan listrik. Struktur Tata Nama Sifat Isomer Identifikasi dan Kegunaan Senyawa. Ikatan kovalen polar adalah ikatan kovalen yang pasangan elektron yang dipakai bersama cenderung tertarik ke salah satu atom yang berikatan.
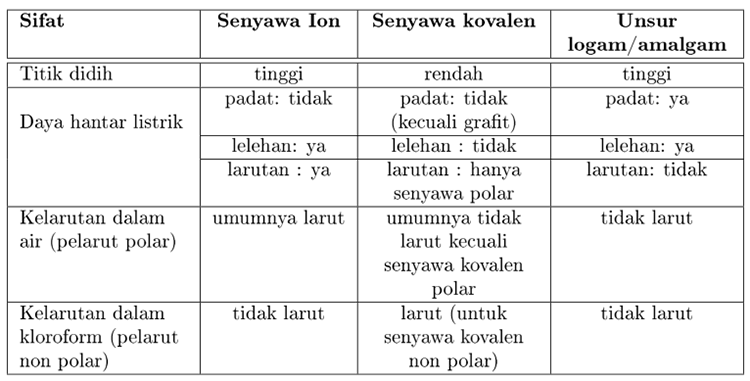
Untuk memahami perbedaan wujud senyawa ionik dan kovalen polar ini berikut penjelasannya. Dapat terbentuk apabila unsur-unsur yang bereaksi mempunyai perbedaan daya tarik elektron yang cukup besar Perbedaan yang besar memungkinkan terjadi serah-terima. Jika momen dipol tidak sama dengan 0 senyawa kovalen tersebut merupakan senyawa kovalen polar.
Senyawa tersebut terbentuk karena unsur-unsur saling berikatan. Hal ini terjadi karena antara dua atom F dan F memiliki keelektronegatifan yang sama besar atau perbedaan elektronegativitas adalah nol. Perlu diingat baik-baik.
Senyawa ion memiliki ikatan ion dalam bentuk lelehan dan larutan dapat terionisasi sempurna menghasilkan ion-ion yang dapat bergerak bebas. Jenis Ikatan Molekul. Ikatan antar atomnya bersifat polar namun molekulnya bersifat nonpolar dikarenakan bentuknya yang simetris dengan sudut sama besar.
NaCl KI dan MgSO4 merupakan senyawa ion. Sedangkan senyawa kovalen kurang begitu polar dan tidak larut dalam air sehingga tidak dapat menghantarkan arus listrik. Hal ini karena air melarutkan zat polar yang merupakan konsistensi senyawa ionik sedangkan senyawa kovalen non-polar.
Ikatan yang terjadi antara ion-ion logam dan non logam Ikatan terbentuk akibat gaya tarik listrik antara ion yang berbeda Ikatan ion juga dikenal sebagai ikatan elektrovalen. Kovalen polar dan non polar dimasukkan dalam kelompok kovalen. Senyawa kovalen memiliki titik didih dan titik leleh yang rendah.
Secara garis besar ikatan antar unsur dibedakan menjadi dua jenis yaitu ikatan logam dan ikatan kovalen. Struktur Tata Nama Sifat Penggunaan dan Penggolongan Makromolekul. Pada suhu kamar berbentuk gas ada juga yang berwujud cair dan padat.
Pada hasil pengamatan terhadap pengujian senyawa ion dan kovalen dengan memanaskan senyawa-senyawa tersebut didapatkan perbedaan titik leleh antara dua senyawa tersebut. SMALarutan Elektrolit dan. Senyawa kovalen tidak dapat menghantarkan listrik.
Senyawa ionik terbentuk oleh transfer elektron yang bermuatan. Contoh pada senyawa CH 4. Jika jumlah momen dipol 0 senyawa kovalen tersebut merupakan senyawa kovalen nonpolar.
Senyawa kovalen tidak larut dalam pelarut polar namun larut dalam pelarut organik. Sekarang kami akan bahas sedikit tentang apa perbedaan antara Senyawa dengan ikatan kovalen polar dan non polar. Tolong jawabannya ya makasihh.
Senyawa kovalen berwujud lunak dan tidak mudah rapuh. Ikatan ion dalam senyawa ionik lebih kuat. Sementara itu senyawa kovalen polar timbul karena perbedaan elektronegativitas yang cukup besar antara dua atom.
Sebaliknya Senyawa non polar terdiri dari beberapa atom yang memiliki keelektronegatifan yang hampir sama misalnya saja H dan C. Senyawa molekuler yang lebih lembut dan lebih fleksibel. Entalpi fusi energi panas yang diserap bila padat mencair dan entalpi penguapan energi panas yang diserap ketika cairan mendidih lebih tinggi dalam senyawa ion.
Pada senyawa ionik elektron diberikan dari atom dari satu unsur ke unsur lainnyaPada senyawa kovalen di samping itu elektron bersama oleh beberapa atom. Padatan wujud ini tidak dapat menghantarkan listrik karena dalam bentuk padatan tidak ada ion yang bergerak secara bebas. Karena PEI tertarik sama kuat maka bentuk molekul pada senyawa F 2 adalah simetris.
Misalnya asam sulfat bila dilarutkan ke dalam air akan membentuk ion hidrogen dan ion sulfat. HF asam florida. INI JAWABAN TERBAIK.
Sifat-sifat senyawa kovalen adalah. Ada tiga jenis ikatan dalam molekulsenyawa yaitu ikatan ion ikatan kovalen polar dan kovalen non polar. Urea mempunyai titik leleh pada kisaran antara 30 95 naftalena antara 30 -61 NaCl antara 85 100 KI antara 62 100 MgSO4 antara 30.
Kesetimbangan Ion dan pH Larutan Garam. Perbedaan antara senyawa ionik dan senyawa molekul. Senyawa kovalen memiliki ikatan kovalen.
Pelarut organik merupakan senyawa karbon misalnya bensin minyak tanah alkohol dan aseton. Senyawa non polar memiliki perbedaan keelektronegatifan yang kecil bahkan untuk senyawa biner dwiatom seperti O2H2 perbedaan keelektronegatifannya 0. Memiliki titik didih dan titik leleh yang relatif rendah.
Jadi perbedaan sifat fisik senyawa ion kovalen dan. Jika dua atom nonlogam sejenis diatomik membentuk suatu senyawa kovalen misalkan H2 N2 Br2 dan I2 maka ikatan kovalen yang terbentuk memiliki keelektronegatifan yang sama atau tidak memiliki perbedaan. Salah satu perbedaan yang tampak antara senyawa kovalen dan senyawa ion dapat dilihat dari wujudnya yaitu pada suhu kamar atau ruangan senyawa ion dapat berbentuk padat sedangkan senyawa kovalen berbentuk cair atau gasTetapi seperti yang kita ketahui dari percobaan bahwa urea adalah senyawa kovalen yang.
Ikatan kovalen terjadi akibat penggunaan bersama-sama pasangan elektron oleh dua atom. Lelehan wujud ini dapat menghantarkan listrik karena dalam bentuk lelehan ion-ionnya bergerak relatif bebas. Ikatan ion membentuk senyawa ion sedangkan ikata kovalen membentuk senyawa kovalen.
Perbedaan senyawa ion dan senyawa kovalen. Ikatan antara unsur-unsur ini beragam bergantung pada jenis unsur.

Buat Yang Kelas 10 Yuk Mengenal Ikatan Ikatan Kimia Dalam Atom

Pengertian Senyawa Kovalen Polar Dan Nonpolar Serta Perbedaannya

Bandingkan Sifat Senyawa Ionik Dan Senyawa Kovalen

Top 10 Perhatikan Data Sifat Fisik Senyawa A Dan B Berikut 2022

Ciri Ciri Dari Senyawa Ion Dan Senyawa Kovalen Brainly Co Id
Modul Rumus Soal Sifat Fisis Senyawa Wardaya College

Pengertian Sifat Dan Contoh Dari Senyawa Ion Panduan Kimia Riset
Perbedaan Ikatan Kovalen Polar Dan Non Polar Ppt Download

Perbedaan Senyawa Ion Senyawa Kovalen Dan Logam Utakatikotak Com

Sebutkan 8 Perbedaan Senyawa Polar Dan Nonpolar Konsep Pentingnya Usaha Tiga Dua Satu

Perbedaan Senyawa Ion Dan Senyawa Kovalen Youtube

Trik Super Kilat Membedakan Senyawa Ion Dan Senyawa Kovalen Youtube

Sebutkan 5 Contoh Perbedaan Antara Senyawa Ion Dan Senyawa Kovalen Brainly Co Id

Sebutkan Perbedaan Sifat Antara Senyawa Ion Dengan Senyawa Kovalen Brainly Co Id

Daya Hantar Listrik Senyawa Ion Kovalen Polar Kovalen Nonpolar Part 8 Otosection
![]()
Perbedaan Sifat Senyawa Ion Dan Senyawa Kovalen Po
Perbedaan Sifat Senyawa Ion Dan Senyawa Kovalen Po

Sebutkan Sifat Atau Ciri Senyawa Kovalen Dan Ion Brainly Co Id